声明:
本文为科普类文章,旨在普及领域相关知识、促进科学传播。
文中所使用的视频、图片、文字等素材,若涉及作品版权问题,请相关权利人及时与我们联系,我们将依法依规妥善处理。
此外,若文章内容存在错误,或与原期刊文章的观点、结论不一致,也欢迎随时告知我们,我们将第一时间进行修改、删除等处理。
同时,热忱欢迎相关领域科研工作者、科普爱好者向我们投稿、荐稿,或洽谈合作事宜,共同助力产业化发展。
骨肉瘤高发于青少年,恶性程度高且易转移。现有保肢疗法(切除+重建+放化疗)面临两大难题:放化疗耐药导致易复发,术后骨再生环境差。传统3D打印骨支架虽具骨传导性,却难以同时实现杀瘤与再生。近日,四川大学程冲、邱逦、张勃庆团队取得重要进展,该团队设计并开发了一种新型的智能3D打印支架(HS-ICTO),该支架能够响应肿瘤微环境和外部超声刺激,智能地从“肿瘤杀伤模式”切换到“组织再生模式”,为骨肉瘤治疗及术后骨缺损修复提供了一种创新的一体化解决方案。
具体相关研究以“Sono-activable and biocatalytic 3D-printed scaffolds for intelligently sequential therapies in osteosarcoma eradication and defect regeneration”为题发表在《Nature Communications》上。

亮点:创新性与突破
(1)智能时序治疗:支架可根据微环境酸碱度自动切换功能——酸性肿瘤环境中高效杀瘤,中性缺损环境中促进再生,无需额外调控。
(2)超声可控性:超声激活可时空精准增强ROS生成,降低对正常组织的毒副作用,实现“按需治疗”。
(3)多功能集成:同时解决肿瘤复发、骨再生障碍、微环境失衡三大难题,减少手术次数。
(4)临床转化潜力:3D打印HA支架机械性能与人体松质骨匹配,生物相容性优异,ICTO稳定性高,可长期发挥作用。
WHAT:研究内容
本文以缓解骨肉瘤治疗中多次侵入性手术的需求为目标,开发了一种新型超声激活且具有生物催化性能的3D打印羟基磷灰石(HA)支架(HS-ICTO),用于骨肉瘤根除和骨缺损再生的智能时序治疗。该支架通过修饰的ICTO纳米颗粒,在肿瘤微环境中借助多酶样机制结合超声激活,迅速产生大量活性氧以增强肿瘤细胞凋亡,而在炎症性骨缺损微环境中,又能智能切换功能,将过氧化氢催化为氧气,有效阻断内源性过氧化氢介导的氧化应激,调控干细胞的成骨分化,最终促进骨缺损再生。
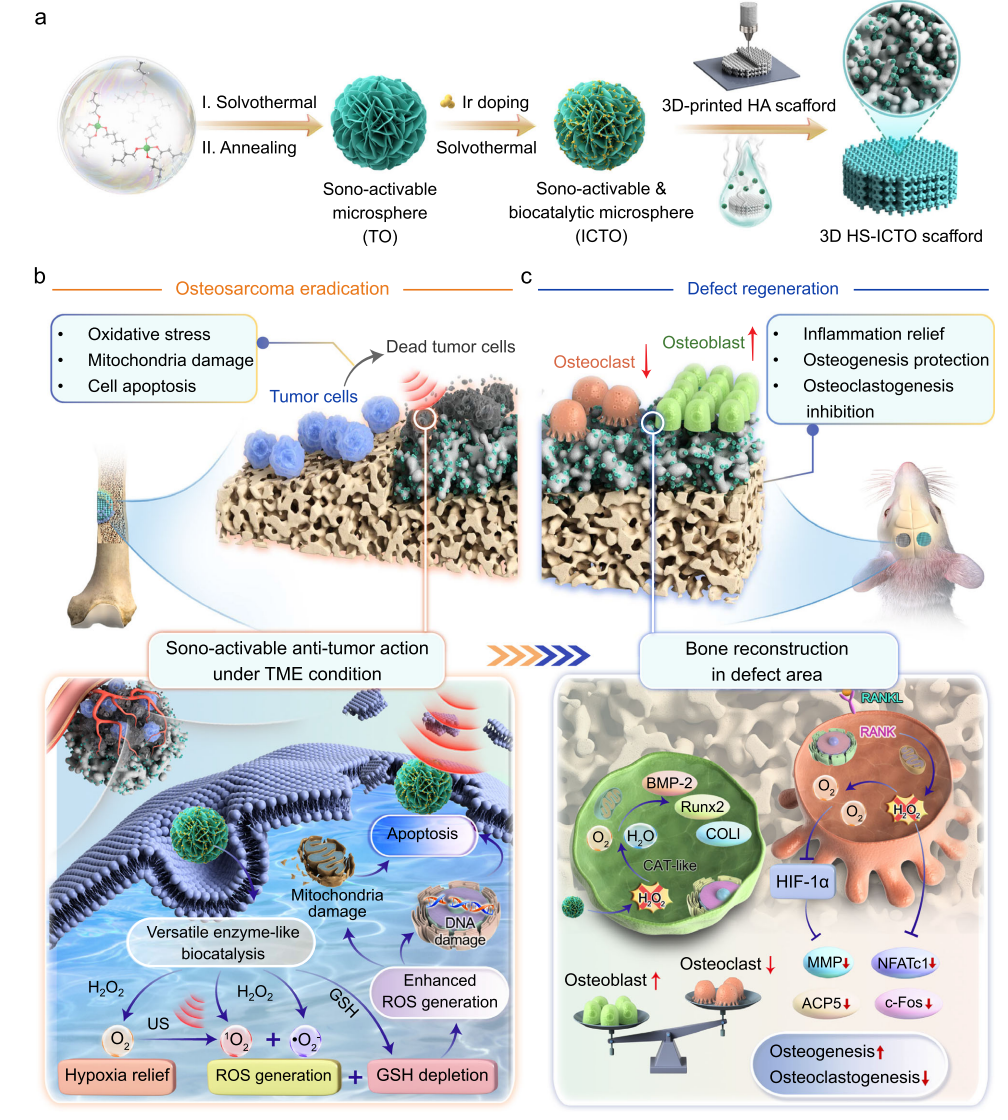
图1 声激活与仿酶催化3D打印支架用于骨肉瘤保肢治疗的设计
WHY:研究背景与意义
骨肉瘤是一种高发于儿童和青少年的高度恶性骨肿瘤,常侵犯长骨,导致骨破坏、疼痛甚至转移。目前主流的保肢疗法(肿瘤切除+骨缺损重+放化疗)面临两大核心困境:一是肿瘤对放化疗耐药,难以实现根治性切除,导致局部复发率高,需多次手术;二是术后骨缺损微环境因炎症和氧化应激失衡,再生能力受限,严重影响患者预后。
现有3D打印骨支架(如羟基磷灰石HA)虽具备骨传导性,但无法兼顾肿瘤杀伤与骨再生,且难以适应复杂的微环境动态变化。因此,开发一种能智能响应肿瘤与骨缺损微环境、实现“先杀瘤后再生”时序治疗的多功能支架,成为突破骨肉瘤治疗瓶颈的关键。
HOW:研究方法
(1)材料合成与表征:采用溶剂热法制备花瓣状TiO₂(TO),通过水热法掺杂Ir形成ICTO纳米颗粒,再经湿沉积法修饰于3D打印HA支架(HS)表面,得到HS-ICTO。利用SEM、TEM、XRD、XPS等技术验证材料结构,通过XANES和EXAFS分析Ir-TiO₂电子耦合作用。
(2)体外实验:酶活性检测:通过TMB显色、EPR自由基捕获等验证ICTO的POD/OXD/CAT活性及超声增强效应。细胞实验:评估HS-ICTO对骨肉瘤细胞(143b)的杀伤效果(活死染色、流式凋亡分析),以及对BMSCs成骨分化的保护作用(ALP、茜素红染色、RT-qPCR)。
(3)体内实验:肿瘤模型:在裸鼠皮下骨肉瘤模型中,验证HS-ICTO联合超声的抑瘤效果(肿瘤体积、凋亡标志物检测)。骨再生模型:在大鼠颅骨缺损模型中,通过Micro-CT、组织染色评估骨再生效率(骨体积、成骨标志物表达)。
(4)机制验证:结合RNA-seq分析差异基因表达,通过DFT计算揭示ICTO的催化反应路径。
解决方案:技术优势
1、材料设计与结构验证
构建基于3D打印羟基磷灰石(HA)支架的HS-ICTO,通过湿沉积法将ICTO纳米颗粒(Ir-TiO₂簇)修饰于支架表面,利用Ir与TiO₂的强电子耦合赋予其多功能催化活性。下图清晰展示了支架的合成路径及“双阶段作用机制”:在肿瘤微环境中,ICTO通过过氧化物酶(POD)、氧化酶(OXD)活性结合超声激活生成活性氧(ROS)杀伤肿瘤;在骨缺损微环境中,切换为过氧化氢酶(CAT)活性分解H₂O₂生成O₂,促进骨再生。通过SEM、TEM等证实,ICTO中Ir簇以1.7nm均匀分布于TiO₂表面,XPS分析显示Ir-O-Ti的电子耦合,保障了催化活性的稳定性;支架机械性能与人体松质骨相当,满足植入需求。
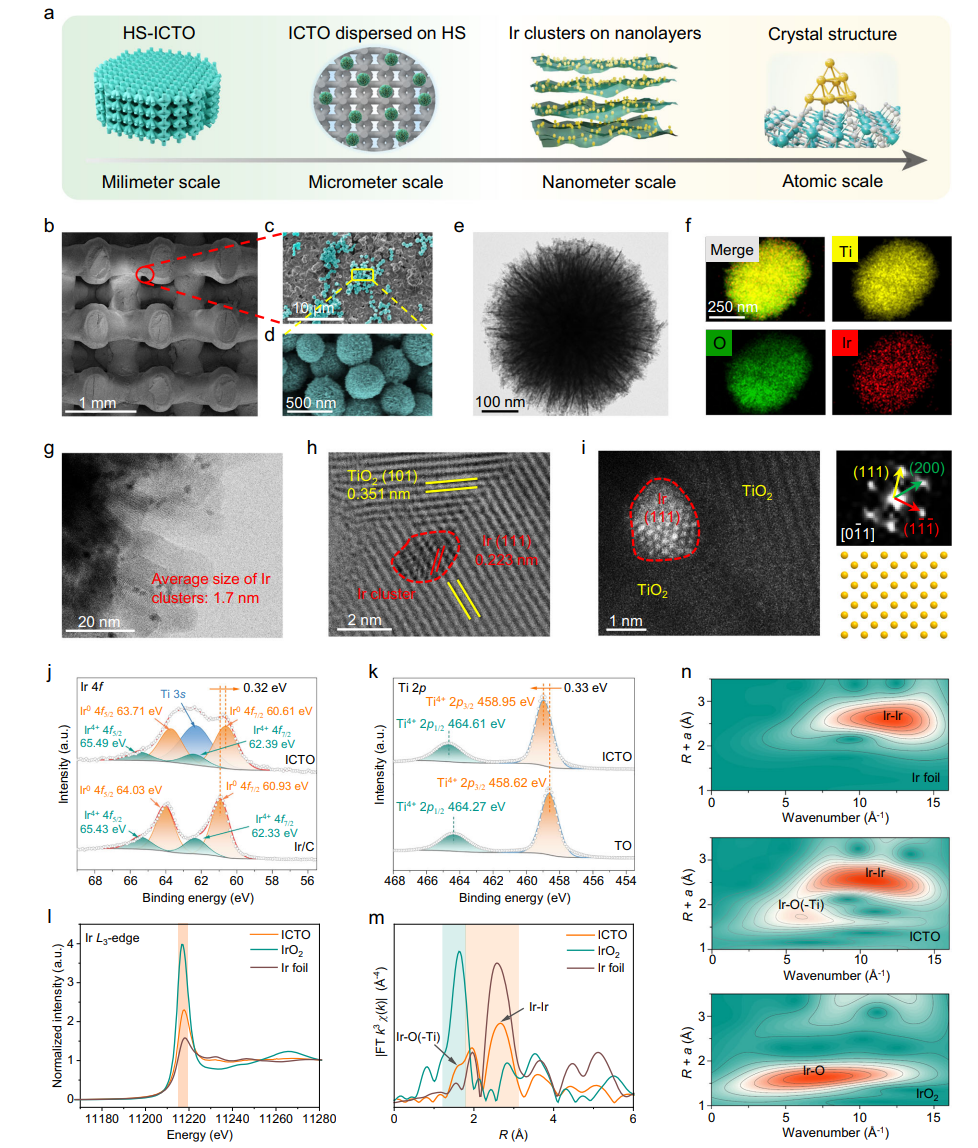
图2 HS-ICTO支架的形貌与结构表征
2、酶活性与催化机制
验证ICTO在不同微环境中的酶活性,揭示其“ROS生成-氧释放”的切换机制。酸性肿瘤环境中,ICTO的POD/OXD活性显著高于单纯TiO₂,通过TMB显色反应高效生成ROS;中性骨缺损环境中,CAT活性可在20分钟内分解90%H₂O₂并持续产氧。DFT计算揭示催化路径:酸性条件下通过Ir-Ti协同位点生成・OOH(能垒0.51eV),中性条件下生成O₂(能垒0.34-0.38eV),证实微环境响应的特异性。
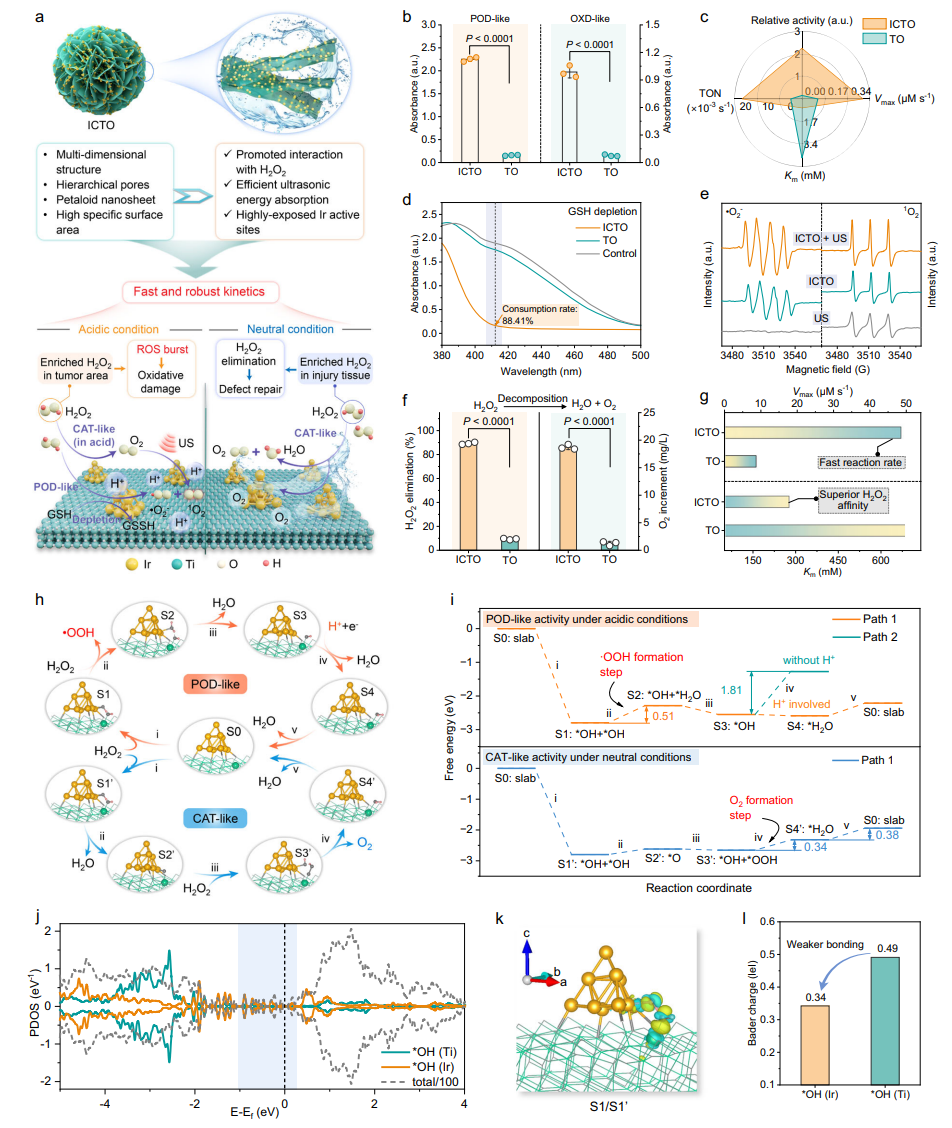
图3 ICTO的仿酶催化活性与理论计算
3、肿瘤杀伤效果
评估了HS-ICTO在体内外对骨肉瘤的杀伤效率及超声协同作用。体外实验显示,HS-ICTO+超声组对143b骨肉瘤细胞凋亡率达87.13%,RNA-seq证实其通过上调凋亡、ROS损伤相关基因发挥作用,且降低HIF-1α表达缓解肿瘤缺氧。体内实验中,裸鼠模型显示HS-ICTO+超声组肿瘤抑制率达90.43%,H&E和TUNEL染色显示肿瘤组织大量凋亡,且支架无明显毒性。
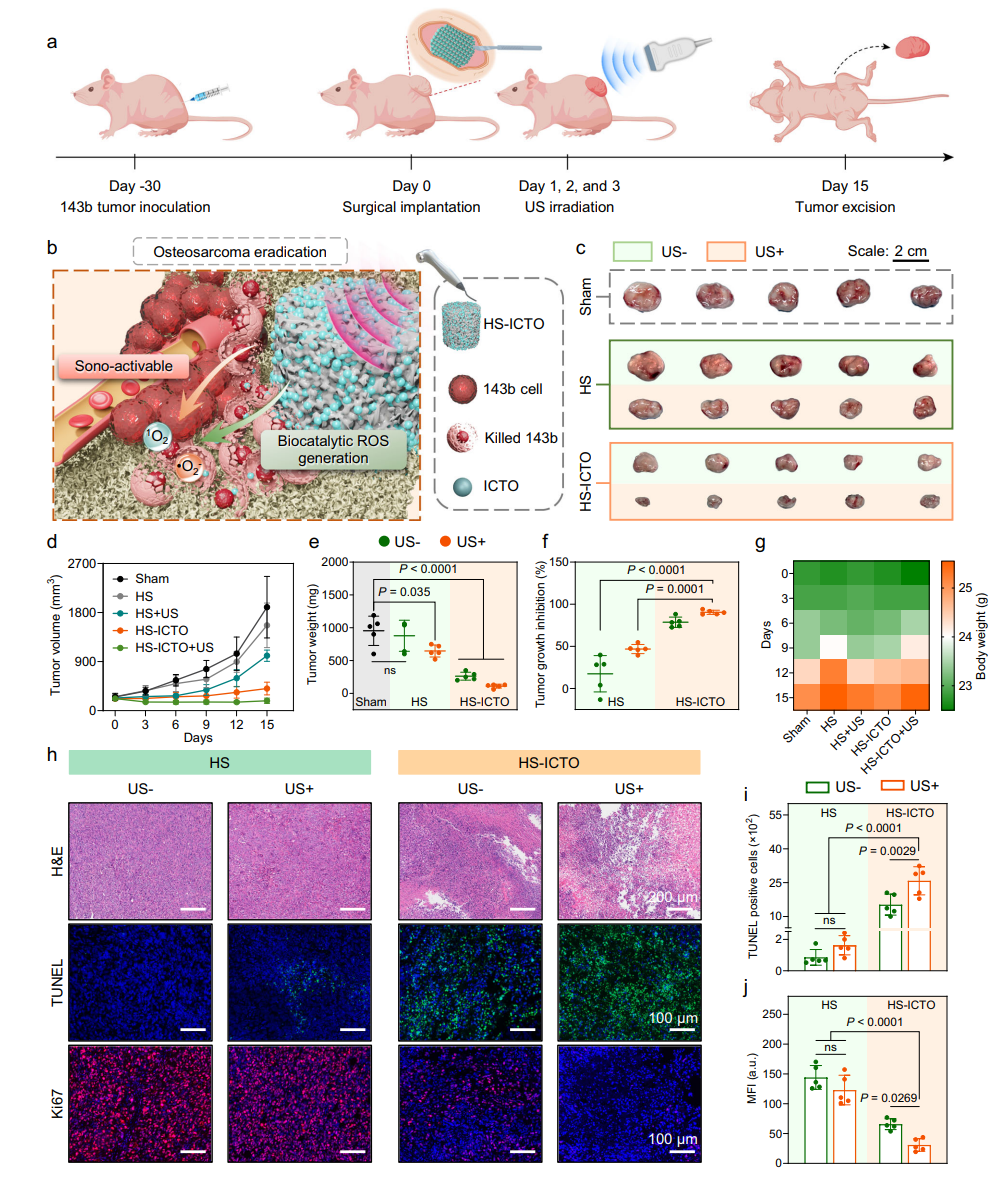
图4 HS-ICTO在体内骨肉瘤异种移植模型中的治疗效果
4、骨再生与微环境调控
研究验证了HS-ICTO对干细胞的保护、成骨分化的促进及破骨细胞的抑制作用。
干细胞保护:HS-ICTO可抵抗H₂O₂损伤,维持骨髓间充质干细胞(BMSCs)活性,ALP和茜素红染色显示成骨能力显著增强,Runx2、BMP-2等成骨基因表达上调。
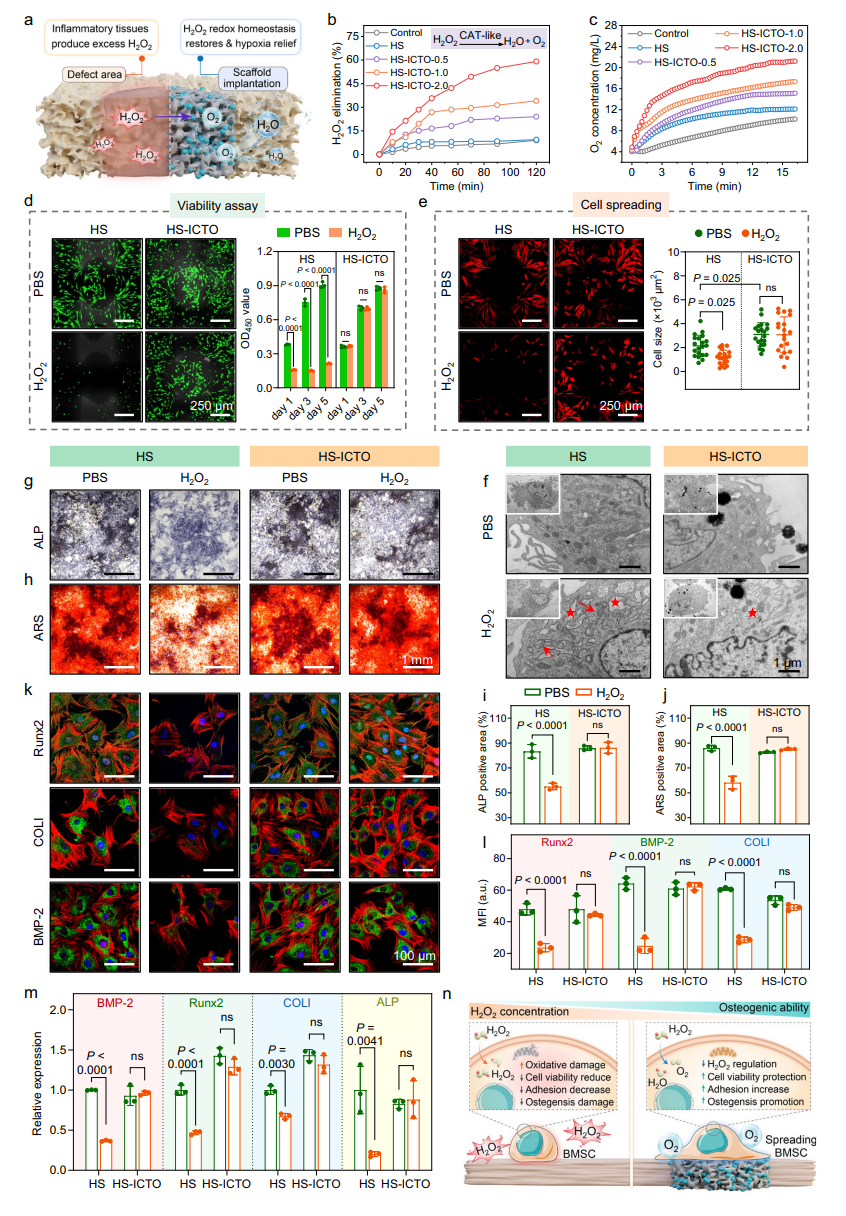
图5 HS-ICTO在体外调控氧化还原稳态并保护干细胞免受氧化应激损伤的作用
破骨抑制:通过抑制NFATc1、MMP-9等基因,减少破骨细胞活性,阻断骨吸收,TRAP染色显示阳性细胞数显著降低。
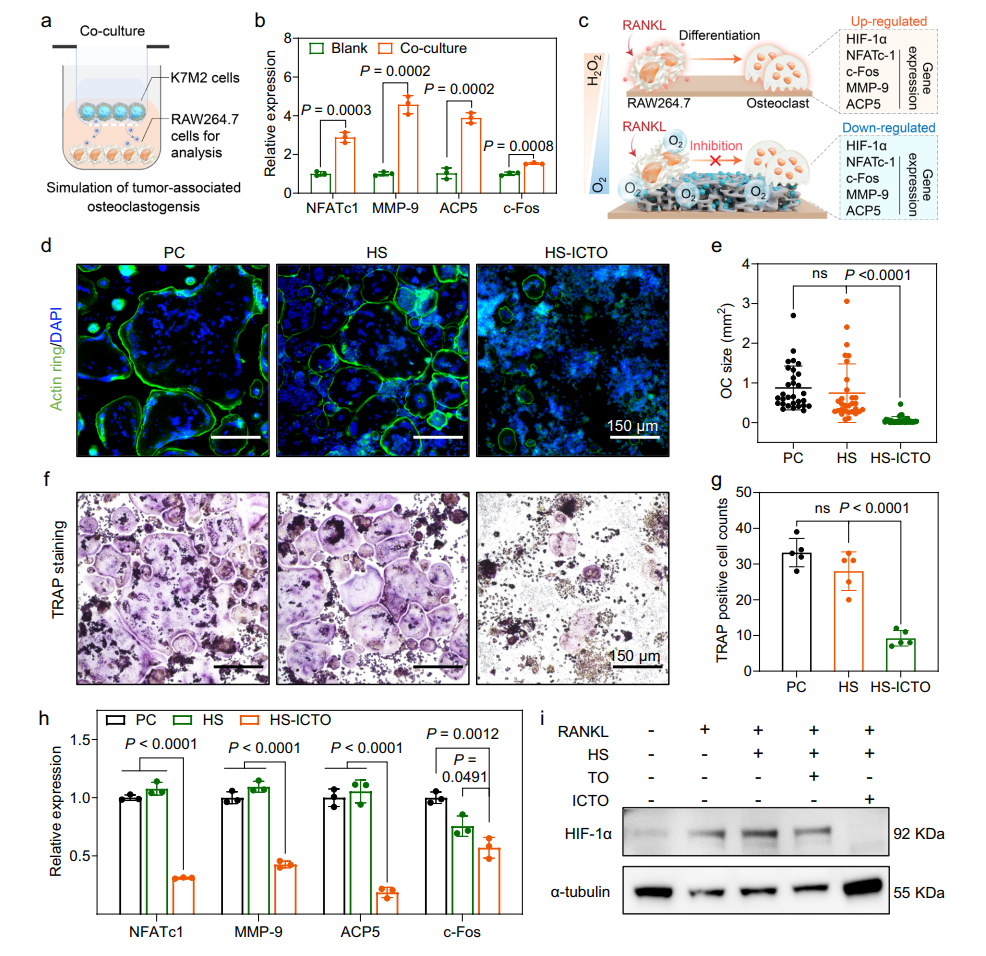
图6 HS-ICTO对破骨细胞形成的抑制作用
骨再生:大鼠颅骨缺损模型中,12周时HS-ICTO组骨体积(BV/TV)达43.6%(显著高于HA组的28.7%,图8h),成骨标志物(Runx2、BMP-2)表达增强,证实高效骨修复能力。
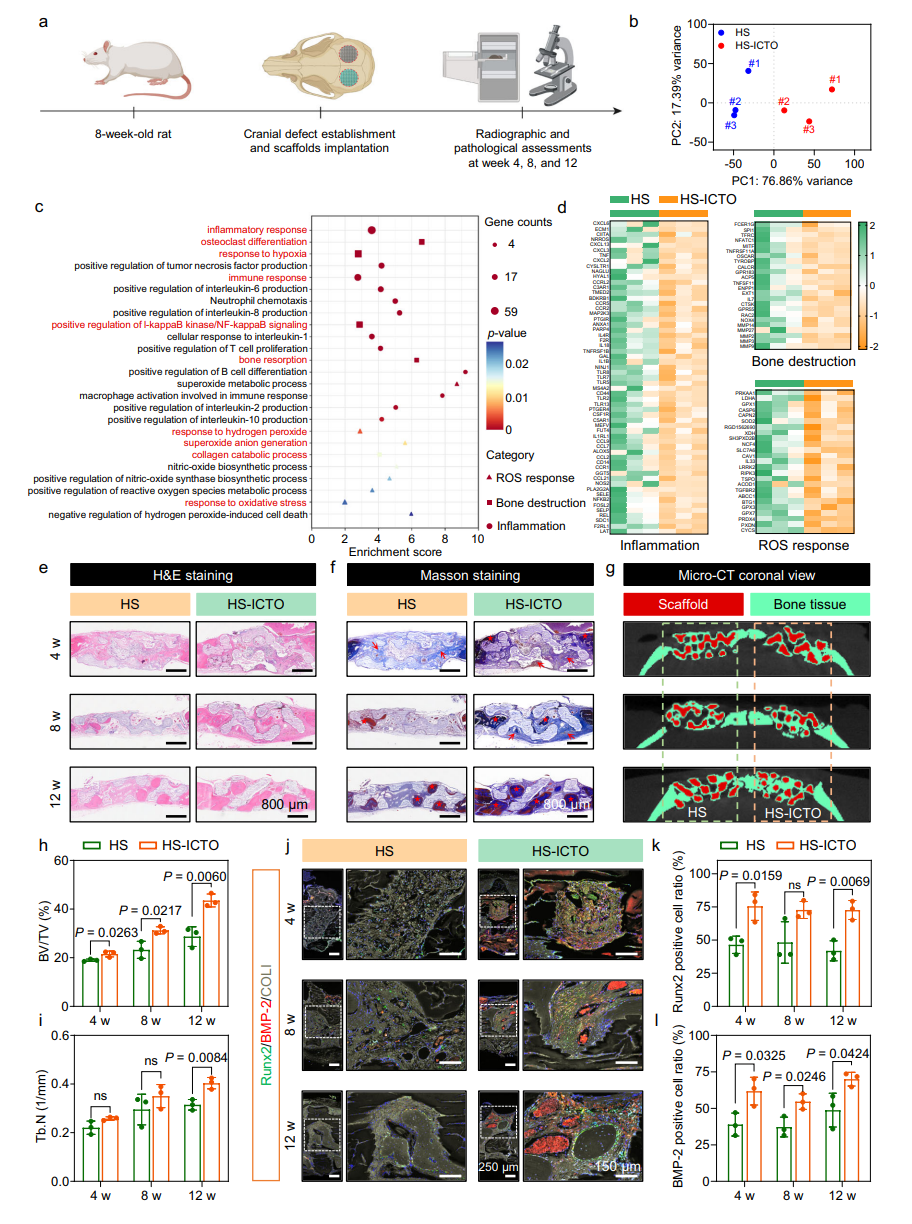
图7 大鼠颅骨缺损模型中的体内骨再生评估
结论
本文以缓解骨肉瘤治疗中多次侵入性手术的需求为目标,开发了一种新型超声激活且具有生物催化性能的3D打印羟基磷灰石(HA)支架(HS-ICTO),用于骨肉瘤根除和骨缺损再生的智能时序治疗。该支架通过修饰的ICTO纳米颗粒,在肿瘤微环境中借助多酶样机制结合超声激活,迅速产生大量活性氧以增强肿瘤细胞凋亡,而在炎症性骨缺损微环境中,又能智能切换功能,将过氧化氢催化为氧气,有效阻断内源性过氧化氢介导的氧化应激,调控干细胞的成骨分化,最终促进骨缺损再生。

