声明:
本文为科普类文章,旨在普及领域相关知识、促进科学传播。文中所使用的视频、图片、文字等素材,若涉及作品版权问题,请相关权利人及时与我们联系,我们将依法依规妥善处理。此外,若文章内容存在错误,或与原期刊文章的观点、结论不一致,也欢迎随时告知我们,我们将第一时间进行修改、删除等处理同时,热忱欢迎相关领域科研工作者、科普爱好者向我们投稿、荐稿,或洽谈合作事宜,共同助力产业化发展。
西安交通大学的李涤尘/贺健康教授团队开发了一种新型电喷印InterPore微纤维晶格,该晶格具有纵向互连孔,旨在通过其各向异性结构促进高密度细胞排列和增强组织互联性,从而在体外重现心肌的结构和功能特性。相关工作以“Engineering Highly Aligned and Densely Populated Cardiac Muscle Bundles via Fibrin Remodeling in 3D-Printed Anisotropic Microfibrous Lattices”为题发表在《Advanced Materials》上。
亮点:创新性与突破
1、InterPore 微纤维晶格的设计与制造:采用电流体打印技术制造具有各向异性结构的InterPore微纤维晶格。晶格由纵向和横向微纤维壁组成,具有交错排列的“V形”结构,增强了孔隙间的纵向连接性。
2、细胞排列与组织形成:InterPore晶格引导细胞沿纵向轴排列,形成连续、高密度的细胞束。在InterPore晶格中,细胞束的形成速度更快,细胞存活率更高,即使在高细胞密度下也能保持组织的完整性和功能。
3、心脏组织的电生理特性:InterPore晶格中的心脏组织表现出同步的钙波传播,表明增强的电耦合和同步收缩能力。在电刺激下,InterPore晶格中的心脏组织表现出更高的最大跳动频率和更低的刺激阈值。
WHAT:研究内容
本文针对心肌组织工程中细胞排列杂乱与电信号传导阻滞的难题,开发了3D打印各向异性微纤维晶格支架。该支架整合双重功能结构:纵向互连孔道通 过"V形交错横向纤维"实现高密度细胞定向排列,引导心肌束连续组装;各向异性拓扑通过力学约束调控纤维蛋白动态重塑,促进细胞间电耦合同步化。3D打印的分级纤维网络保障机械稳定性与营养渗透,实现结构引导与细胞自组装的时空协同。经体外细胞实验、电生理表征及动物模型验证,该支架显著提升心肌组织收缩同步率和钙信号传导效率,为心脏病治疗和药物筛选提供了高仿生工程平台。
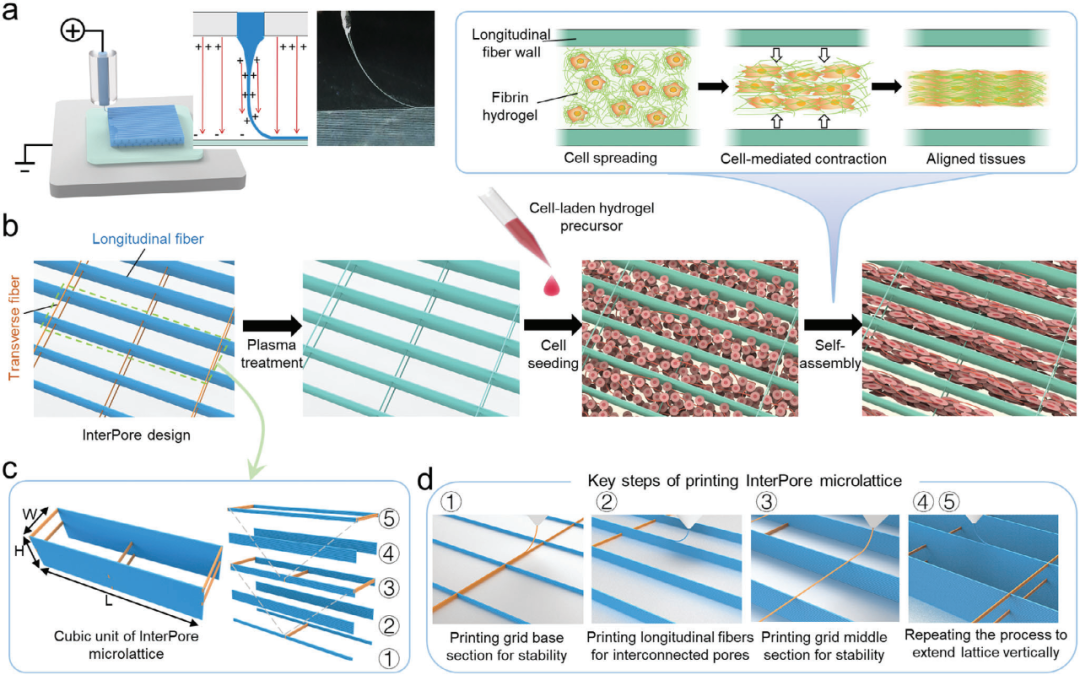
图1 InterPore 微纤维晶格的设计与制备
WHY:研究背景与意义
心脏组织的功能依赖于心肌细胞(cardiomyocytes,CMs)的高度对齐和电信号同步传导,以维持高效收缩和血液泵送。然而,心肌梗死等病理条件会破坏这种结构,导致功能失调。传统心肌组织工程方法(如电纺支架或水凝胶系统)存在局限:细胞对齐不足、电信号传导受阻、机械稳定性差,且难以实现高细胞密度(接近天然心肌的108-109cells/cm³)。本研究开发一种各向异性的3D打印支架,通过引导细胞介导的纤维蛋白重塑,形成高对齐、高密度的连续心肌束,实现时空协同的细胞排列和电生理功能优化,为心脏修复提供新平台。
HOW:研究方法
1、支架的制造:采用医疗级聚己内酯(PCL)作为核心支架材料,通过电液动力(EHD)打印技术,分步制造各向异性微纤维晶格支架:创新性引入"V形交错横向纤维",支架经等离子体处理后负载纤维蛋白水凝胶。
2、支架的表征:通过SEM、微CT三维重建以及力学性能的测试对其微观形貌 和结构进行表征;通过细胞介导重塑追踪和电生理功能验证,评估支架对心肌细胞的修复功能;
3、多尺度效能验证:通过免疫荧光染色、基因时序表达、钙瞬变和节拍率分析 进行工程化心脏组织的功能评估;通过药理敏感性验证其对药物具有一定的智能响应性,利用多次播种实验和有限元模评估其对血管化组织的构建。
解决方案:技术优势
1、InterPore 微纤维晶格构建新生大鼠心脏组织通过将新生大鼠心肌细胞接种到纤维蛋白水凝胶并在不同晶格中培养,研究 InterPore 微纤维晶格对心脏组织发育的促进能力,结果表明在该晶格中培养的心脏组织具有更成熟的结构和电生理活性。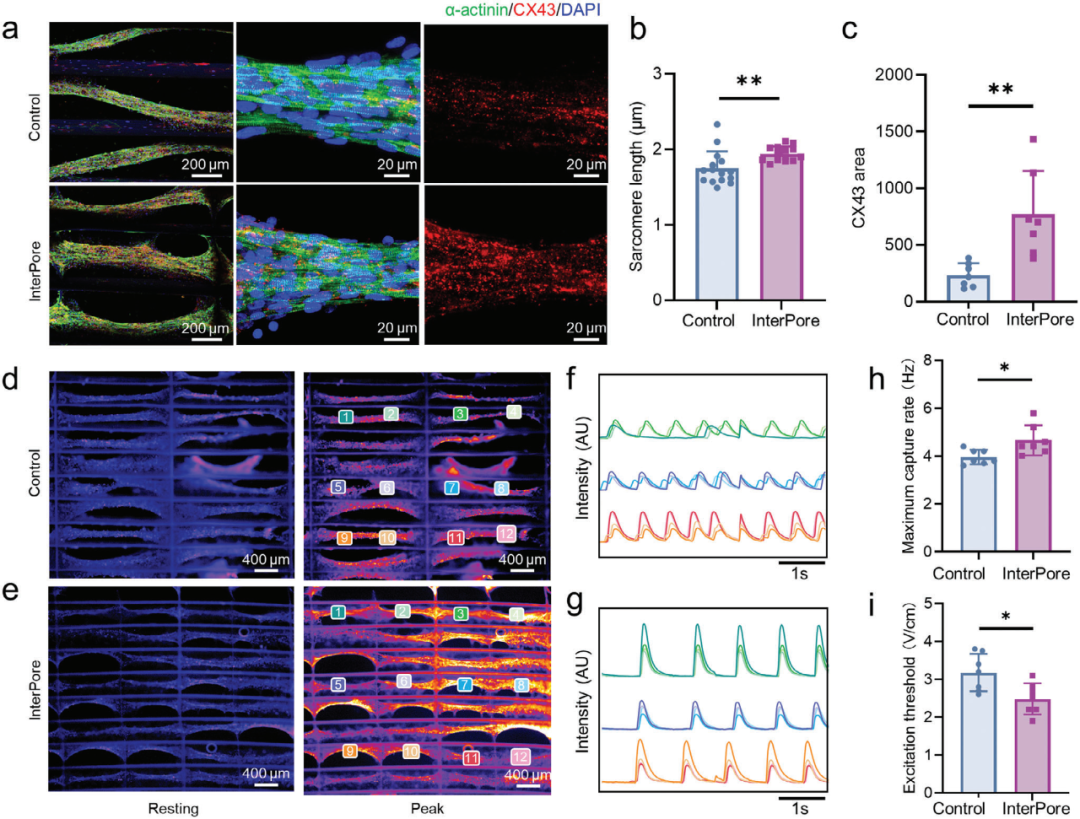
图2 工程化排列心脏组织的结构表征和电生理功能
2、多次播种循环增强细胞负载和多细胞组织形成
利用多次播种实验和有限元模拟,研究多次播种循环对InterPore微纤维晶格细胞负载和多细胞组织形成的影响,结果显示多次播种可提高细胞密度且维持高细胞活力,还能构建预血管化心脏组织。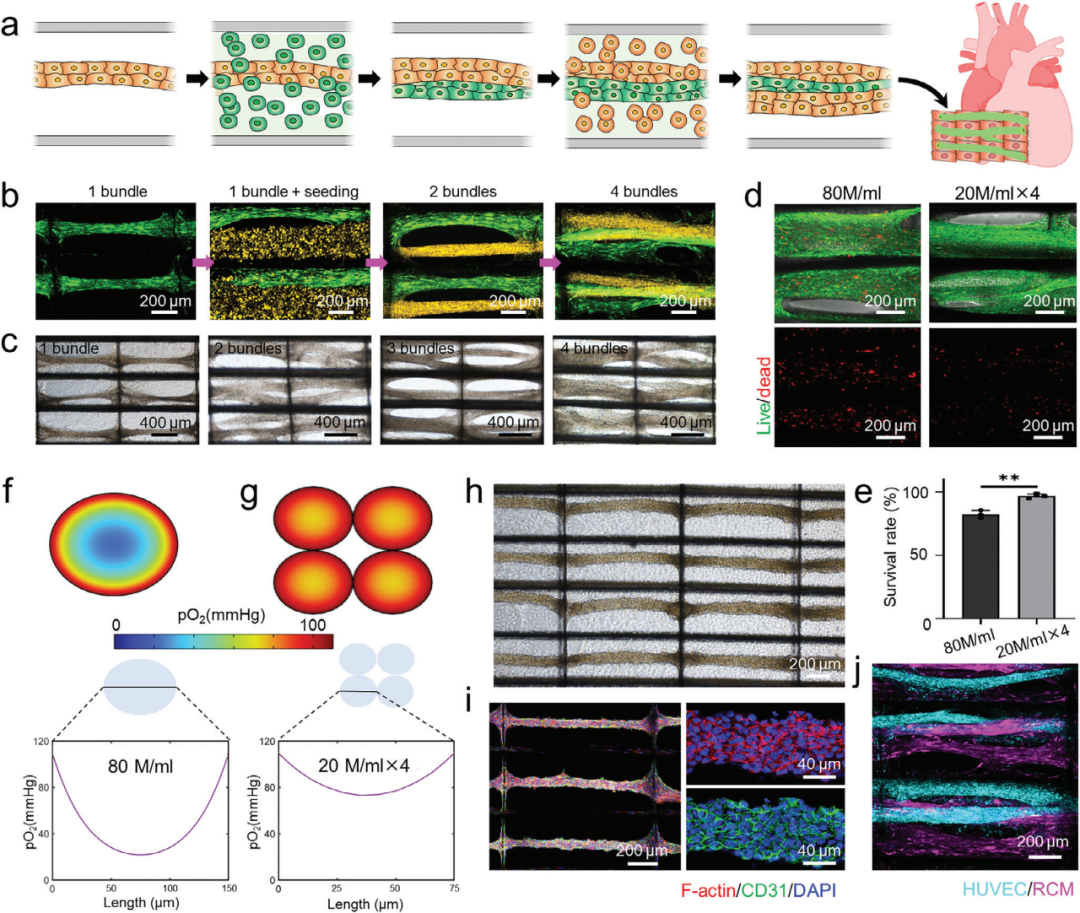
图3 InterPore微纤维晶格中多次播种循环促进细胞负载增强和多细胞组织工程
3、从hiPSC-CMs构建功能性人类心脏组织
采用细胞培养、钙成像、基因表达分析和药物处理等方法,研究InterPore 微纤维晶格中使用hiPSC-CMs构建功能性人类心脏组织的过程,结果表明该晶 格能促进hiPSC-CMs功能成熟,构建的组织对药物有响应,可用于药物测试。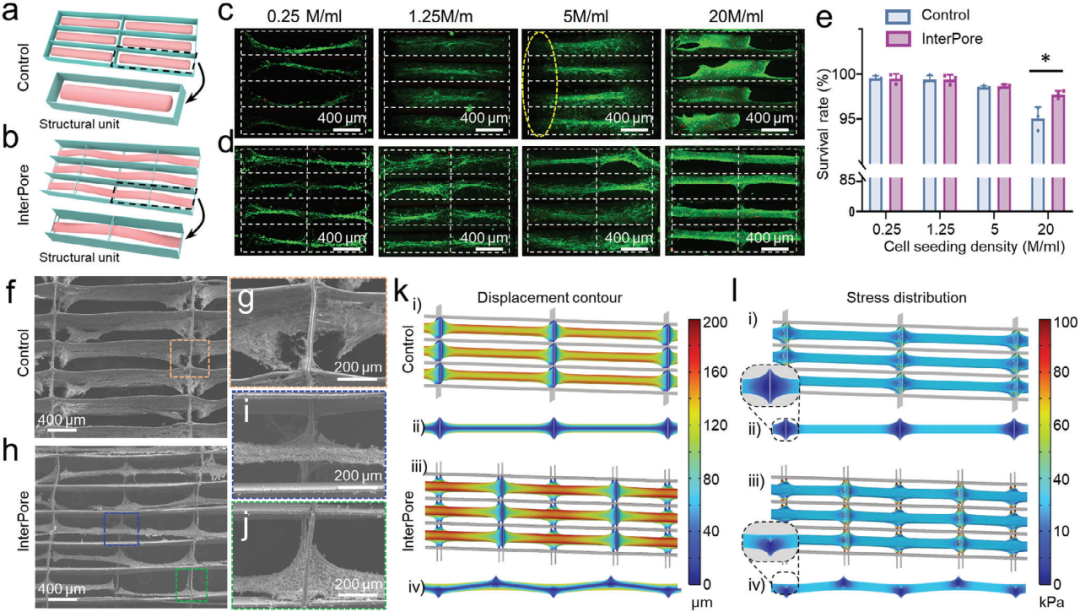
图4 InterPore 微纤维晶格中从hiPSC-CMs构建的工程化排列人类心脏组织的表征
结论
此研究开发了一种各向异性3D打印的InterPore纤维晶格,用于心肌细胞的修复。通过将精确的结构控制与仿生纤维蛋白水凝胶重塑相结合,该平台实现了高度对齐、密集的心肌束,具有增强的电生理和力学特性。晶格的纵向相互连接的孔不仅促进了高密度细胞组织和强大的相互连接性,还支持血管生成和功能性组织成熟等关键过程。展望未来,这种方法在疾病建模、药物筛选和再生疗法中具有巨大的推进应用潜力为心脏组织工程提供了可扩展、高仿生的技术平台。

